日本循環器学会を含む10学会・研究会より構成される部会による監修で、109施設で実施
日本・東京--(BUSINESS WIRE)--Impella(インペラ)心臓ポンプで治療された日本人の患者を対象とした医師主導の3年間の前向き研究において、Impellaによって治療された心筋梗塞による心原性ショック患者の30日後の生存率が77%であることが示されました。一般的に、心原性ショックを発症した患者の生存率は約50%であると言われていますが、今回の中間解析ではそれを上回る生存率を示しました。日本循環器学会を含む日本の10の学会・研究会からなる補助人工心臓治療関連学会協議会 インペラ部会が実施したこの臨床試験は、J-PVAD(補助循環用ポンプカテーテルに関するレジストリ事業)のデータを用いてImpellaの有効性と安全性を検討した初めての研究で、このデータは独立行政法人医薬品医療機器総合機構(PMDA)に共有されています。この中間解析結果は、本日開催された第84回日本循環器学会学術集会において、研究代表医師である大阪大学大学院 医学系研究科 外科学講座 心臓血管外科学教授の澤芳樹先生によって発表されました。
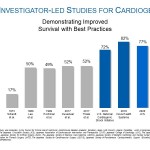

中間解析では、日本の臨床使用開始の第一症例から、109施設で心原性ショックや劇症型心筋炎などの様々な病態に対してImpellaを留置された連続819名の全患者を解析しました。上記データに加え、劇症型心筋炎の患者の30日後の生存率は88%で、Impellaによる治療がとくに心筋炎に対して非常に有効な治療法であることが本研究で示されました。全体として、30日後の生存率が良好であることから、Impellaは患者さんにとって有効な治療法であると結論づけられています。
大阪大学大学院 医学系研究科 外科学講座 心臓血管外科学教授であり、日本胸部外科学会理事長である澤芳樹先生は次のように述べています。「今回のデータは薬剤治療抵抗性の急性心不全患者にImpellaを早期に使用することで、心原性ショックやその他の生命を脅かす重篤な状態にある患者の生存率と自己心臓の回復率を一貫して高く維持できることを示しています。Impellaの使用において、日本の医療従事者の皆さんがImpella部会の指導とプロトコルに沿って患者さんのために新しい治療法を安全に日本に導入し、高い生存率を実現してくださったことに心より感謝申し上げます。」
植木らによる2015年の日本における心原性ショックの生存率分析では、体外式膜人工肺(ECMO)による静脈・大動脈からの心肺補助(V-A ECMO)治療を受けた患者の30日後の生存率は32%でした。本研究が示したImpella治療による高い生存率は、適切なタイミングでのImpella留置、心原性ショックの早期発見、右心室カテーテルの使用、強心剤使用量低減など、確立されたベストプラクティスに沿って治療することで達成されました。ベストプラクティスの使用に関して本研究で得られた知見は、National Cardiogenic Shock Initiative 試験(NCSI)や、TehraniらによるINOVA試験などで発表された医師主導の研究と一致しており、Impellaをベストプラクティスに基づいたプロトコルで使用することで、患者さんの生存率が有意に向上することが示されています(図1)
ヘンリーフォード病院心臓病センターのメディカルディレクターであり、NCSI試験の治験責任医師でもあるウィリアム・オニール医師は次のように述べています。「すでにあるベストプラクティスに沿ってImpellaを使用すれば、心原性ショックの患者さんの生存率が大幅に改善されることがこの心強い研究によって示されています。私は、世界中の医師に対して、心原性ショックの患者さんにImpellaを早期に使用することの合理性を示した日本のデータを参考にするように勧めます。」
オンライン動画では、澤芳樹先生とアビオメッドの最高医療責任者(CMO)であるチャック・サイモントン医師が、日本の医師が高い生存率を達成するうえでImpellaの使用とベストプラクティスがどのように役立ったのか意見を交換しています。ビデオはこちらからご覧いただけます。
Impellaによる自己心臓の回復は、心臓移植数の少ない日本において特に重要な医学的知見です。J-PVADを企画する補助人工心臓治療関連学会協議会インペラ部会は以下の10学会・研究会により構成されます。
・一般社団法人 日本循環器学会
・一般社団法人 日本心血管インターベンション治療学会
・一般社団法人 日本心臓病学会
・一般社団法人 日本心不全学会
・一般社団法人 日本人口臓器学会
・一般社団法人 日本集中治療医学会
・特定非営利活動法人 日本小児循環器学会
・特定非営利活動法人 日本胸部外科学会
・特定非営利活動法人 日本心臓血管外科学会
・日本経皮的心肺補助研究会
Impella心臓ポンプは、アビオメッド(NASDAQ:ABMD)が製造しており、14年以上のFDA研究、12万5千人以上の患者さんを対象としたリアルワールド臨床データ、650件以上の査読付き論文など、米国FDAの歴史上もっとも研究されている機械的循環補助装置です。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術またはバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国食品医薬品局(FDA)より市販前承認(PMA)を取得している心内留置型ポンプです。Impella 2.5、Impella CP、SmartAssist®搭載Impella CP、Impella 5.0®、Impella LD®、SmartAssist®搭載Impella 5.5™は、心原性ショック状態にある急性心不全心筋症患者の治療に使用する心臓ポンプとして米国食品医薬品局(FDA)の承認を取得しており、心臓の自然な回復を可能にする独自の機能を有しているため患者さんが自分の心機能を回復させ帰宅することができます。Impella RP®は、右室不全および左心補助人工心臓の埋込、心筋梗塞、心臓移植、開胸手術後に発生する非代償性心不全の治療を目的として米国食品医薬品局(FDA)の承認を受けています。またImpella RPは、病院環境における医療提供者(HCP)による緊急使用として、体表面積1.5 m2以上の救急患者さんを対象に最長14日間までの一時的な右心室補助の実施、さらには肺塞栓症(PE)を含め、コロナウイルス感染症(COVID-19)と関連した合併症に起因する急性右心不全または代償不全の治療を目的とした使用も認められています。Impella RPはCOVID-19と関連した合併症に起因する急性右心不全または代償不全の治療用として承認されていません。Impella RPは、上記の緊急使用につきEUAに基づくFDAの認可を受けており、認可が終了するか早期取り消しされない限り、連邦法 21 U.S.C. § 360bbb-3(b)(1)の564(b)(1)条に基づく医療機器の緊急使用承認を正当化する状況が存在するという宣言の期間中に限って認可されています。
欧州でImpella 2.5、Impella CP、SmartAssist搭載Impella CPは、高リスクPCIおよび心原性ショックショックを伴う急性心筋梗塞(AMI)の患者さんの最長5日間の治療を対象としてCEマークを取得しています。Impella 5.0およびImpella LDは、心原性ショックを伴う心臓発作または心筋症の患者さんの最長10日間の治療を対象としてCEマークを取得しています。SmartAssist®搭載Impella 5.5™は、急性心不全または心原性ショックを伴う心筋症の患者さんの最長30日間の治療を対象としてCEマークを取得しています。Impella RPは、右心不全および左心補助人工心臓埋込、心筋梗塞、心臓移植、開胸術後に発生する代償不全に陥った心不全の治療デバイスとしてCEマークを取得しています。
承認された適応症や、デバイスの使用に伴う重要な安全性・リスク情報を含め、Impella心臓ポンププラットフォームの詳細については、www.impella.com をご覧ください
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、心臓のポンプ機能を補助することで心筋の負担を軽減し、その回復を目指しています。詳細情報についてはwww.abiomed.com. をご覧ください。Abiomed、Impella、Impella 2.5、Impella 5.0、Impella 5.5、 Impella LD、Impella CP、Impella RP、SmartAssist、Impella Connectは、アビオメッドの登録商標で、米国および一定の外国で登録されています。Impella BTR、Impella 5.5、Impella ECP、CVAD Study、STEMI DTU Studyはアビオメッドが商標登録出願中です。
将来見通しに関する記述
本リリースは、アビオメッドの既存製品および新製品の開発、営業活動による企業としての成長、将来的可能性、および行政当局による承認の見込みに関する記述等の将来の見通しに関する記述が含まれます。当社の実績は多くの要因によりこの将来の見通しに関する記述の中で記載とは大きく異なる可能性があり、それらの要因には、COVID-19の世界的流行病がもたらす影響の範囲・規模・期間、開発、試験、関連行政当局による承認に伴う不確定要素(将来の損失の可能性を含む)、さらには将来的な損失が生じる可能性、複雑な製造工程、高品質に関する要件、限られた供給源への依存、競争、技術的変更、行政規制、訴訟問題、今後の資金需要と追加資金の不確実性に加え、直近に提出したForm 10-Kの年次報告書とその後SECに提出・提供した書類を含め、証券取引委員会に提出した当社の報告書に記載されたその他のリスクおよび課題が含まれます。利用者は、本プレスリリースの発表日時点に述べられている将来の見通しに関するいかなる記述についても過度に依拠することのないようお願いいたします。当社は、本プレスリリースの発行日以降に発生する事象、または予想外の出来事の発生によって、見通しまたは予測など、当社の将来の業績に関する見通しを更新し、または修正する義務を負うものではありません。これらの訂正は、本リリースの日付以降に発生する出来事や状況を反映させたり、予想外の出来事を反映させたりする場合に行われる可能性があります。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
Contacts
Sarah Karr
Communications Manager
978-882-8211
skarr@abiomed.com
